Contenido
- Examen físico e historial
- Análisis de sangre
- Aspiración y biopsia de médula ósea
- Citoquímica
- Estudios de cromosomas y genes
- Otros procedimientos
- Imágenes
- Diagnóstico diferencial
- Puesta en escena
Luego se realizan pruebas adicionales para buscar marcadores de superficie en las células (citometría de flujo), así como cambios genéticos (pruebas citogenéticas). Con algunas leucemias, también se puede examinar una punción lumbar (punción lumbar) o una biopsia de ganglio linfático.
El cáncer, si se detecta, se clasifica luego en función de factores como los síntomas, el subtipo de leucemia, la cantidad de células anormales en la sangre o la médula ósea y más.
Cuando se habla del diagnóstico de leucemia, es importante recordar que la leucemia no es una enfermedad ni siquiera cuatro enfermedades. Más bien, existen muchas variaciones diferentes.
Dos leucemias que parecen idénticas bajo el microscopio pueden comportarse de manera muy diferente, y algunas de las pruebas a continuación pueden ayudar a distinguir algunas de las diferencias.
Examen físico e historial
La historia y el examen físico son el punto de partida en el diagnóstico de leucemia y lo que a menudo impulsa a los médicos a solicitar más estudios, pero no se pueden usar solos para hacer el diagnóstico.
Si se sospecha leucemia, su médico le preguntará sobre cualquier síntoma de leucemia y los factores de riesgo de la enfermedad que pueda tener. Un examen físico puede revelar signos de la presencia de leucemia, como inflamación de los ganglios linfáticos, piel pálida o hematomas. Si bien son notables, si están presentes, pueden indicar otras preocupaciones. Su médico tendrá en cuenta su presencia.
Guía de discusión del médico de leucemia
Obtenga nuestra guía imprimible para su próxima cita con el médico para ayudarlo a hacer las preguntas correctas.

Análisis de sangre
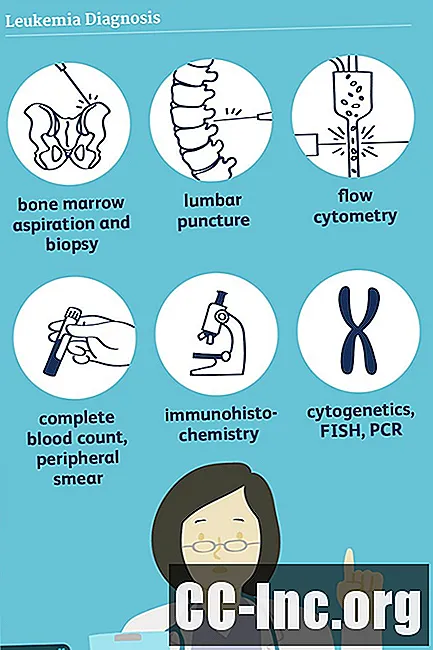
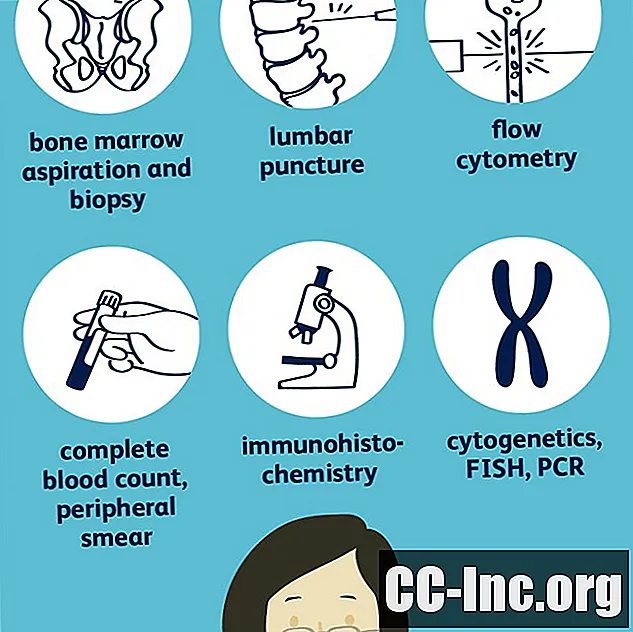
Tanto un hemograma completo como un frotis periférico, análisis de sangre simples, pueden brindar pistas importantes sobre el diagnóstico y el tipo de leucemia, y guiar una evaluación adicional.
Recuento completo de células sanguíneas y frotis de sangre periférica
UNAhemograma completo (CBC) mide la cantidad de cada uno de los principales tipos de glóbulos producidos por la médula ósea: glóbulos blancos, glóbulos rojos y plaquetas. El CBC también puede producir resultados que transmiten información importante sobre estas células, como si los glóbulos rojos son grandes o pequeños.
Si bien a menudo hay un aumento de glóbulos blancos con la leucemia, en la leucemia aguda a veces hay un disminución en todos los tipos de células sanguíneas, una afección conocida como pancitopenia.
UNA frotis periférico es una prueba muy importante cuando se considera el diagnóstico de leucemia. En un frotis periférico, se extiende una muestra de sangre en un portaobjetos de microscopio y se agrega un tinte. Luego, el frotis se evalúa bajo un microscopio.
Un hemograma completo puede determinar si un recuento de glóbulos blancos es bajo o alto, pero no brinda suficiente información sobre el tipo de glóbulos blancos que aumentan o disminuyen.
Tampoco le dice al médico si hay glóbulos blancos inmaduros llamados "blastos" en los glóbulos periféricos que normalmente solo se encuentran en cantidades significativas en la médula ósea.
Un frotis periférico puede responder estas preguntas al permitir que los técnicos y médicos observen directamente las células bajo el microscopio.
Los hallazgos típicos (estos pueden variar) en un CBC y un frotis de sangre para los cuatro tipos principales de leucemia incluyen:
Enfermedad | Resultados CBC | Resultados del frotis de sangre |
Leucemia mielógena aguda (AML) | Cantidades más bajas de lo normal de glóbulos rojos y plaquetas | Muchos glóbulos blancos inmaduros y, a veces, la presencia de bastones de Auer |
Leucemia linfocítica aguda (ALL) | Cantidades más bajas de lo normal de glóbulos rojos y plaquetas | Muchos glóbulos blancos inmaduros |
Leucemia mielógena crónica (LMC) | • El recuento de glóbulos rojos puede ser alto y el recuento de plaquetas puede ser alto o bajo | • Puede mostrar algunos glóbulos blancos inmaduros |
Leucemia linfocítica crónica (CLL) | • Los glóbulos rojos y las plaquetas pueden disminuir o no | • Poco o ningún glóbulo blanco inmaduro |
Algunas de las pruebas que se describen a continuación, como la citoquímica, también se pueden realizar en sangre periférica.
Aspiración y biopsia de médula ósea
Con la mayoría de los tipos de leucemia, los análisis de sangre no son suficientes para diagnosticar de manera concluyente la enfermedad, y se realiza una aspiración y una biopsia de médula ósea. (Con CLL, el diagnóstico a veces se puede hacer basándose en los análisis de sangre anteriores, pero la médula ósea aún puede ser útil para determinar qué tan avanzado está el cáncer). La médula ósea es la fuente de las células cancerosas en la leucemia y todos los células sanguíneas que se encuentran en la sangre periférica.
Con una aspiración de médula ósea, se inserta una aguja larga y delgada en la médula ósea de la cadera (o, a veces, el esternón) después de adormecer la piel localmente con lidocaína. Después de aspirar una muestra de médula ósea, también se toma una muestra de biopsia.
En la médula ósea normal, entre el 1 y el 5 por ciento de las células son células blásticas o glóbulos blancos inmaduros que maduran para convertirse en los que normalmente se encuentran en la sangre.
Se puede hacer un diagnóstico de ALL si al menos el 20% de las células son blastos (linfoblastos). Con AML, se puede hacer un diagnóstico si hay menos del 20% de blastos (mieloblastos) si también se encuentra un cambio cromosómico específico.
Además de observar la cantidad de células diferentes presentes en la médula ósea, los médicos también observan el patrón de las células. Por ejemplo, con CLL, el pronóstico de la enfermedad es mejor si las células cancerosas se encuentran en grupos (patrón nodular o intersticial) que si se encuentran dispersas de manera difusa alrededor de la médula ósea.
La proporción de células leucémicas a células sanas formadoras de sangre puede ser significativa en el proceso de diagnóstico.
Citoquímica
La citoquímica analiza cómo las células de la médula ósea absorben ciertas manchas y puede ser útil para distinguir la ALL de la AML. Las pruebas pueden incluir tanto citometría de flujo como inmunohistoquímica.
En citometría de flujo, las células de la médula ósea (o células sanguíneas periféricas) se recubren con anticuerpos para buscar la presencia de ciertas proteínas que se encuentran en la superficie de las células. Los anticuerpos se adhieren a estas proteínas y pueden detectarse por la luz que emiten cuando se introduce un láser.
Inmunohistoquímica es similar, pero en lugar de usar un láser para buscar la luz emitida por las proteínas marcadas con anticuerpos, se pueden ver al microscopio debido a un cambio de color.
Este proceso de búsqueda de proteínas únicas en la superficie de las células se denomina inmunofenotipificación. En genética, el genotipo se refiere a las características de un gen, mientras que el fenotipo describe las características físicas (como los ojos azules). Los diferentes tipos de leucemia difieren en estos fenotipos.
En el caso de las leucemias agudas (tanto de LLA como de LMA), estos estudios pueden ser útiles para determinar el subtipo de la enfermedad y, en el caso de LLA, pueden determinar si la leucemia involucra células T o células B.
Además, estas pruebas pueden ser muy útiles para confirmar un diagnóstico de CLL (al buscar proteínas llamadas ZAP-70 y CD38).
La citometría de flujo también se puede utilizar para determinar la cantidad de ADN en las células leucémicas, lo que puede ser útil para planificar el tratamiento. Las células de ALL que tienen más ADN que una célula promedio tienden a responder mejor a la quimioterapia.
Estudios de cromosomas y genes
Las células de leucemia muy a menudo tienen cambios en los cromosomas o genes que se encuentran en el ADN de cada célula. Cada una de nuestras células tiene normalmente 46 cromosomas, 23 de cada padre, que contienen muchos genes. Algunos estudios analizan principalmente los cambios cromosómicos, mientras que otros buscan cambios en genes específicos.
Citogenética
La citogenética implica ver los cromosomas de las células cancerosas bajo el microscopio y buscar anomalías.
Debido al método por el cual se hace esto (las células cancerosas necesitan tiempo para crecer en el laboratorio después de ser recuperadas), los resultados de estos estudios a menudo no están disponibles hasta dos o tres semanas después de que se realiza una biopsia de médula ósea.
Los cambios cromosómicos que se pueden observar en las células leucémicas incluyen:
- Deleciones: falta parte de un cromosoma.
- Translocaciones: se intercambian piezas de dos cromosomas. Este puede ser un intercambio completo, en el que partes de ADN simplemente se intercambian entre dos cromosomas, o uno parcial. Por ejemplo, el ADN puede intercambiarse entre los cromosomas 9 y 22. Las translocaciones cromosómicas son muy comunes en la leucemia y ocurren en hasta el 50 por ciento de estos cánceres.
- Inversión: parte de un cromosoma permanece presente, pero se da la vuelta (como si se quitara y se reemplazara una pieza de un rompecabezas, pero al revés).
- Adición o duplicación: se encuentran copias adicionales de todo o parte de un cromosoma.
- Trisomía: hay tres copias de uno de los cromosomas, en lugar de dos.
Además de definir mejor el tipo de leucemia, la citogenética puede ayudar a planificar el tratamiento. Por ejemplo, en la LLA, las células leucémicas que tienen más de 50 cromosomas responden mejor al tratamiento.
Hibridación fluorescente in situ (FISH)
La hibridación fluorescente in situ (FISH) es un procedimiento que utiliza tintes especiales para buscar cambios en los cromosomas que no se pueden detectar con el microscopio o cambios en genes específicos.
Con leucemia mielógena crónica (LMC), esta prueba puede buscar piezas del gen de fusión BCR / ABL1 (cromosoma Filadelfia).
Aproximadamente el 95% de las personas con CML tendrán este cromosoma 22 acortado, pero el otro 5% aún tendrá el gen de fusión anormal BCR / ABL1 en más pruebas. El cromosoma Filadelfia también es un hallazgo importante en la ALL.
Con CLL, la citogenética es menos útil y FISH y PCR son más importantes para encontrar cambios genéticos.Hay muchas anomalías genéticas que pueden observarse en estos estudios, incluidas deleciones en el brazo largo del cromosoma 13 (en la mitad de las personas con la enfermedad), una copia adicional del cromosoma 12 (trisomía 12), deleciones en el 17 y 11 cromosoma y mutaciones específicas en genes como NOTCH1, SF3B1 y más.
Reacción en cadena de la polimerasa (PCR)
Al igual que FISH, la reacción en cadena de la polimerasa (PCR) puede encontrar cambios en los cromosomas y genes que no se pueden ver a través de la citogenética. La PCR también es útil para encontrar cambios que están presentes en solo unas pocas, pero no todas, las células cancerosas.
La PCR es muy sensible para encontrar el gen BCR / ABL, incluso cuando no se encuentran otros signos de CML en las pruebas cromosómicas.
Otros procedimientos
Además de evaluar los glóbulos blancos en la sangre y la médula ósea, a veces se realizan otros procedimientos.
Punción lumbar (punción lumbar)
Con algunos tipos de leucemia, se puede realizar una punción lumbar (punción lumbar) para buscar la presencia de células leucémicas que se han diseminado al líquido que rodea el cerebro y la médula espinal. También se puede realizar en personas con ALL como personas con AML que tienen algún síntoma neurológico que sugiera esta diseminación.
En una punción lumbar, una persona se acuesta en una mesa de lado con las rodillas hacia arriba y la cabeza hacia abajo. Después de limpiar y adormecer el área, el médico inserta una aguja larga y delgada en la parte baja de la espalda, entre las vértebras y en el espacio que rodea la médula espinal. Luego se extrae líquido y se envía a un patólogo para que lo analice.
Biopsia de ganglio linfático
Las biopsias de ganglios linfáticos, en las que se extirpa parte o la totalidad de un ganglio linfático, se realizan con poca frecuencia con leucemia. Se puede realizar una biopsia de ganglio linfático con CLL si hay ganglios linfáticos grandes o si se cree que la CLL se puede haber transformado en un linfoma.
Imágenes
Las pruebas por imágenes no se suelen utilizar como método de diagnóstico para la leucemia, ya que los cánceres relacionados con la sangre, como la leucemia, no suelen formar tumores. Sin embargo, puede ser útil para estadificar algunas leucemias, como la CLL.
Rayos X
Las radiografías, como una radiografía de tórax o una radiografía de huesos, no se utilizan para diagnosticar la leucemia, pero pueden dar los primeros signos de que algo anda mal. Una radiografía puede mostrar agrandamiento de los ganglios linfáticos o adelgazamiento de los huesos (osteopenia).
Tomografía computarizada (tomografía computarizada)
Una tomografía computarizada usa una serie de rayos X para crear una imagen tridimensional del interior del cuerpo. La tomografía computarizada puede ser útil para observar los ganglios del tórax u otras regiones del cuerpo, así como para notar el agrandamiento del bazo o el hígado.
Imágenes por resonancia magnética (IRM)
Una resonancia magnética utiliza imanes para crear una imagen del interior del cuerpo y no implica radiación. Puede ser útil en las leucemias que afectan al cerebro o la médula espinal.
Tomografía por emisión de positrones (PET / CT o PET / MRI)
En una exploración por TEP, se inyecta glucosa radiactiva en el cuerpo, donde es absorbida por células que son más metabólicamente activas (como las células cancerosas). La PET es más útil con tumores sólidos que con leucemia, pero puede ser útil con algunas leucemias crónicas, especialmente cuando existe preocupación por la transformación en linfoma.
Diagnóstico diferencial
Hay algunas enfermedades que, al menos con las pruebas iniciales, pueden parecerse a la leucemia. Algunos de estos incluyen:
- Ciertas infecciones virales: por ejemplo, el virus de Epstein-Barr (la causa de la mononucleosis infecciosa), el citomegalovirus y el VIH pueden causar un número elevado de linfocitos atípicos en los análisis de sangre.
- Síndromes mielodisplásicos: son enfermedades de la médula ósea que tienen predilección por convertirse en LMA y, a veces, se las denomina preleucemia.
- Trastornos mieloproliferativos: afecciones como la policitemia vera, la trombocitosis esencial, la mielofibrosis primaria y más pueden parecerse a la leucemia antes de la realización de los métodos de prueba en profundidad anteriores.
- Anemia aplásica: Afección en la que la médula ósea deja de producir todos los tipos de células sanguíneas.
Puesta en escena
Una vez que se ha confirmado la leucemia, se debe estadificar. La estadificación se refiere al sistema que utilizan los médicos para clasificar un cáncer. Determinar el estadio de un cáncer, en general, puede ayudar a los médicos a seleccionar el tratamiento más apropiado, así como a estimar el pronóstico de la enfermedad.
La estadificación difiere entre los diferentes tipos de leucemia. Dado que muchas leucemias no forman masas sólidas, la estadificación (con la excepción de la CLL) es muy diferente a la de los tumores sólidos como el cáncer de mama o el cáncer de pulmón.
Se pueden tener en cuenta varios estudios al asignar una etapa, como la cantidad de glóbulos blancos inmaduros que se encuentran en la sangre o la médula ósea, marcadores tumorales, estudios de cromosomas y más.
Al observar la estadificación, nuevamente es importante tener en cuenta que la leucemia es una amplia gama de enfermedades. Dos personas con el mismo tipo de leucemia y la misma etapa pueden tener respuestas muy diferentes al tratamiento, así como diferentes pronósticos.
Leucemia linfocítica crónica (CLL)
Para la leucemia linfocítica crónica, se pueden utilizar varios sistemas de estadificación diferentes. El más común es el sistema Rai. En este sistema, a las leucemias se les asigna una etapa entre la etapa 0 y la etapa 4 en función de la presencia de varios hallazgos:
- Gran cantidad de linfocitos
- Ganglios linfáticos agrandados
- Un hígado y / o bazo agrandados
- Anemia
- Niveles bajos de plaquetas
Según estas etapas, los cánceres se dividen en categorías de riesgo bajo, intermedio y alto.
Por el contrario, el sistema Binet utilizado en Europa separa estas leucemias en solo tres etapas:
- Estadio A: menos de 3 ganglios linfáticos
- Estadio B: más de 3 ganglios linfáticos afectados
- Etapa C: cualquier número de ganglios linfáticos, pero combinado con anemia o un nivel bajo de plaquetas.
Leucemia linfocítica aguda (ALL)
Para la leucemia linfocítica aguda, la estadificación es diferente, ya que la enfermedad no forma masas tumorales que se extiendan gradualmente desde un tumor original.
La ALL probablemente se diseminará a otros órganos incluso antes de que se detecte, por lo que, en lugar de utilizar los métodos tradicionales de estadificación, los médicos suelen tener en cuenta el subtipo de ALL y la edad de la persona.
Esto generalmente implica pruebas citogenéticas, citometría de flujo y otras pruebas de laboratorio.
En lugar de utilizar etapas (las que se usaban en el pasado son en gran medida obsoletas), la LLA se define con mayor frecuencia por las "fases" de la enfermedad. Estos incluyen:
- TODOS sin tratar
- TODO en remisión
- Enfermedad mínima residual
- TODO refractario
- ALL en recaída (recurrente)
Leucemia mielógena aguda (AML)
Al igual que en la LLA, la leucemia mielógena aguda generalmente no se detecta hasta que se ha diseminado a otros órganos, por lo que la estadificación tradicional del cáncer no es aplicable. La estadificación está determinada por características como el subtipo de leucemia, la edad de una persona y más.
Un sistema de estadificación más antiguo, la clasificación franco-estadounidense-británica (FAB), clasificó la AML en ocho subtipos, M0 a M7, según la apariencia de las células bajo el microscopio.
La Organización Mundial de la Salud (OMS) desarrolló un sistema diferente para la estadificación de la AML con la esperanza de predecir más de cerca el pronóstico de la enfermedad.
En este sistema, estas leucemias están separadas por características tales como anomalías cromosómicas en las células (algunos cambios cromosómicos se asocian con un pronóstico mejor que el promedio, mientras que otros se asocian con peores resultados), ya sea que el cáncer surgió después de una quimioterapia previa o radiación (cánceres secundarios), los relacionados con el síndrome de Down y más.
Leucemia mielógena crónica (LMC)
Para la leucemia mieloide crónica, es común la presencia de un mayor número de células maduras pertenecientes al linaje mieloide (como los neutrófilos). La estadificación se determina en función del número de células mieloides inmaduras en diferentes etapas de maduración:
- Fase crónica: en esta etapa más temprana, hay menos del 10 por ciento de blastos en la sangre o la médula ósea y los síntomas son leves o ausentes. Las personas en la fase crónica de la leucemia mieloide crónica suelen responder bien al tratamiento.
- Fase acelerada: en la siguiente fase, del 10 al 20 por ciento de las células en la sangre o la médula ósea son blastos. Los síntomas se vuelven más pronunciados, particularmente fiebre y pérdida de peso. Las pruebas pueden revelar nuevos cambios cromosómicos además del cromosoma Filadelfia. Es posible que las personas en la fase acelerada de la CML no respondan al tratamiento.
- Fase blástica (fase agresiva): en la fase blástica de la LMC, más del 20 por ciento de las células en la sangre o la médula ósea son blastos, y las células blásticas también pueden diseminarse a áreas del cuerpo fuera de la médula ósea. Durante esta fase, los síntomas incluyen fatiga, fiebre y agrandamiento del bazo (crisis blástica).